2023. 5. 13. 14:34ㆍ기계공학 개념/열역학 (Thermodynamics)
열역학 개념 정리(6) - 열역학 제 2법칙과 카르노 사이클

1. 열역학 제 2법칙 개요
열역학 제 2법칙은 엔트로피의 법칙으로, 고립된 시스템에서 엔트로피의 변화량은 항상 0이거나 0보다 크다는 법칙을 의미해요. 일반적으로 전체 사이클의 과정에서는 엔트로피가 증가하는 방향으로 나아가지만, 개별 상변화 과정에서는 엔트로피가 증가할 수도 혹은 감소할 수도 있습니다. 예를 들어 특정 물체의 온도가 증가하면, 이는 엔트로피가 증가하는 것이지만 온도가 떨어지면 엔트로피가 감소하는 것과 같이 모든물질의 상변화에서 엔트로피가 증가하는 방향으로 진행되는 것은 아니에요
이런 열역학 제 2법칙의 기초가 되는 원리는 시스템이 일을 수행할 때 방향성이 있다는 것이에요. 예를 들어 열기관의 경우 고온에서 열을 받아 저온으로 이를 전달하며 일을 수행합니다. 그래서 일반적으로 꾸준한 열원의 공급이 없다는 전제 하에 고온의 온도는 시간이 지남에 따라 떨어지고, 저온의 온도는 상승해 열 평형에 다다르는 것을 일상 생활에서 찾아볼 수 있죠. 하지만 만약 이런 방향성이 없다면 일을 수행함에 따라 고온부의 온도는 시간이 지남에 따라 점점 높아지고, 저온부는 점점 낮아지는, 자연적으로 나타나지 않는 현상이 발생하게 됩니다. 이와 비슷하기 액체에 특정 염료를 뿌렸을 때 색이 확산되는 것은 가능하지만, 이를 다시 한 점으로 모이게 하는 것은 불가능하다는 것 역시 이런 자연에서의 방향성의 또 다른 사례라고 할 수 있어요
과거 포스팅에서 간략하게 열역학 제 2법칙에 대해 소개했듯이, 열역학 제 2법칙을 서술한 사례는 여러 가지가 있어요. Clausiss는 이를 "열기관에서는 저온부에서 고온부로 열을 전달할 수 없다"라 정의하기도 했고, Kelvin-Planck의 서술에 따르면 "효율이 100%인 열기관을 제작할 수 없다"라고 정의되기도 했습니다. 또한 단열과정에 의한 서술을 참고하면 "단열과정에서 내부에너지가 감소하는 방향으로 과정을 진행시킬 수 없다"와 같은 표현법을 찾아볼 수 있기도 합니다.
언제나 동력기계와 시스템에서 효율을 높이는 것은 중요하기에, 이에 대한 연구도 꾸준히 이뤄졌는데요. 열 손실이 없이 시스템이 원래 상태로 돌아갈 수 있는 가역과정이 가장 높은 효율을 보일 수 있음은 자명했고, 이를 근거로 전 사이클의 과정을 가역과정만으로 구성한 카르노 사이클(Carnot Cycle)이 등장하게 됩니다.
2. 카르노 사이클

카르노 사이클은 1824년 프랑스의 Sadi Carnot가 제안한 시스템으로, 모든 과정이 가역과정으로 구성되어 가장 높은 효율을 낼 수 있는 이상적인 열기관을 뜻해요. 카르노사이클은 2개의 등온과정과 2개의 단열과정으로 구성되어 있습니다. 이를 조금 더 자세히 말하면 열공급과 열방출 과정에서는 등온과정으로 동작하고, 고온부와 저온부 사이에서는 단열과정으로 동작하는 것이죠. 한 마디로 말하면 (1) 가역등온팽창(흡혈과정), (2) 가역단열팽창(단열팽창, 고온에서 저온으로 가는 과정), (3) 가역등온압축 (방열과정), (4) 가역단열압축(단열압축, 고온에서 저온으로 가는 과정) 으로 나뉘게 된다는 것이죠. 이를 식으로 표현하면 아래와 같이 정리됩니다.
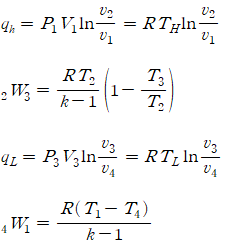
사이클의 전체 과정에서 전달되는 열량을 살펴보면 열기관은 고온부에서 Qh라는 열원을 전달받아 저온열원에 Ql의 열을 방출한 다음 다시 원래 온도로 돌아가는 과정을 거칩니다. 그리고 이 과정에서 다음과 같은 2가지 카르노 정리가 나왔다고 하네요
1) 두 열원 사이에서 작동하는 어떤 열기관의 효율도 카르노 사이클의 열기관 효율보다 높을 수 없다
2) 두 열원 사이에서 작동하는 모든 카르노 사이클의 열기관 효율은 동일하다
카르노사이클의 효율에 대해 고민해 볼 수 있어요. 일반적으로 어떤 기계의 효율은 투입한 에너지 대비 일의 양으로 그 효율을 구해주는데요.카르노사이클에서 일단 공급되는 열원으로는 시스템의 온도를 Th까지 높아지는데 필요한 Qh를 말할 수 있어요. 그리고 시스템이 하는 일은 단열과정을 통해 Qh에서 Ql로 온도가 떨어지는 과정에서 일을 수행하는 만큼 W = Qh-Ql이 되겠죠. 이를 활용해 카르노사이클의 전체 효율은 아래와 같이 나타낼 수 있습니다.
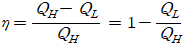
카르노 사이클이 완벽한 가역정이라는 점을 고려한다면 효율에 대한 식을 변형할 수 있어요. 위에 있는 공식에 따르면 카르노사이클은 고온에서의 열전달량 Qh와 저온으로의 열전달량 Ql에 의해 결정되는데요. 각 과정에서 계산되는 Qh와 Ql의 식을 조금 유심히 살펴보면 각 식이 ln(v2/v1)과 ln(v3/v4)로 이뤄진 것을 볼 수 있어요. 이 때 카르노사이클은 완벽한 가역과정인만큼 v2/v1 = v3/v4가 되면서 효율 계산 과정에서 ln함수부를 제거할 수 있게 되며 카르노사이클의 효율을 온도만으로 나타낼 수 있게됩니다. 해당 과정을 다시 거친다면 카르노사이클의 열 효율은 아래와 같이 온도만을 활용해 표현할 수 있게 됩니다.

'기계공학 개념 > 열역학 (Thermodynamics)' 카테고리의 다른 글
| 엔탈피와 엔트로피의 관계 및 이상기체의 엔트로피 유도 (2) | 2023.05.13 |
|---|---|
| 엔트로피의 개념과 실제 열교환 과정에서의 엔트로피 (0) | 2023.05.13 |
| 이상기체의 등온과정, 단열과정, 폴리트로픽 과정에서의 상태량 변화 (0) | 2023.05.13 |
| 이상기체의 정압과정, 정적과정에서 변화 (1) | 2023.05.12 |
| 열역학 제 1법칙과 건도, 엔탈피의 개념 (2) | 2023.05.11 |